循环伏安法(CV)是最重要的电分析化学研究方法之一。在电化学、无机化学、有机化学、生物化学的研究领域广泛应用。由于它仪器简单、操作方便、图谱解析直观,常常是首先的实验的方法。
CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。这种方法也常称为三角波线性电位扫描方法。图1中表明了施加电压的变化方式:起扫电位为0.8V,反向起扫电位为-0.2V,终点又回到0.8V,扫描速度可从斜率反映出来,其值为50mV/s,虚线表示的是第二次循环。
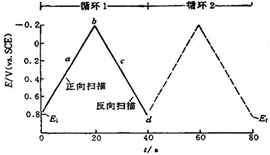
图1循环伏安法的典型激发信号
三角波电位,转换电位为0.8V和-0.2V(vs.SCE)
若电极反应为O+e-→R,反应前溶液中只含有反应粒子O,且O和R在溶液中均可溶,控制扫描起始电势从比体系标准平衡电势(φ平)正得多的起始电势(φi)处开始势作正向电扫描,电流响应曲线则如图2所示。
当电极电势逐渐负移到(φ平)附近时,O开始在电极上还原,有法拉第电流通过。由于电势越来越负,电极表面反应物O的浓度逐渐下降,因此向电极表面的流量和电流就增加。当O的表面浓度下降到近于零,电流也增加到最大值Ipc,然后电流逐渐下降。当电势达到(φr)后,改为反向扫描。
随着电极电势逐渐变正,电极附近可氧化的R粒子的浓度较大,在电势接近并通过(φ平)时,表面上的电化学平衡应当向着越来越有利于生成R的方向发展。于是R开始被氧化,并且电流增大到峰值氧化电流Ipa,随后又由于R的显著消耗而引起电流衰降。整个曲线称为“循环伏安曲线”。
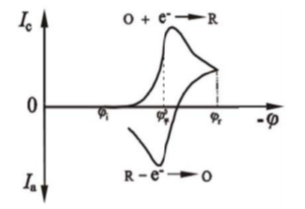
图2 CV扫描电流相应曲线
图3为一个典型的循环伏安曲线。图中,电压从负到正可以看作是正扫为阳极氧化过程,对应氧化峰;反之为负扫阴极还原过程,对应还原峰。阴极反应的电流称为阴极电流,对应还原峰;阳极反应的电流称为阳极电流,对应氧化峰。一般国内规定阴极电流用正值阳极用负值,国外很多文献反之。通常,氧化峰位于较正的电位而还原峰位于较负的电位,这是极化作用的结果。
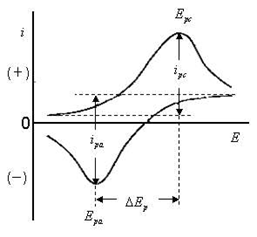
图3典型循环伏安曲线
循环伏安图中可得到的几个重要参数是:阳极峰电流Ipa,阴极峰电流Ipc,阳极峰电位Epa和阴极峰电位Epc。测量确定Ip的方法是:沿基线作切线外推至峰下,从峰顶作垂线至切线,其间高度即为Ip(见图3)。Ep可直接从横轴与峰顶对应处而读取。
通常,还原峰(向上的峰)峰电位越正峰电流越大,越容易还原;氧化峰(向下的峰)峰电位越负,峰电流越大,越容易氧化。对一个简单的电极反应过程,判别电极反应可逆程度的判据为:
Ipa=Ipc (Ipa、Ipc正比于V1/2)
Epa-Epc≈60 mV(25℃条件下)